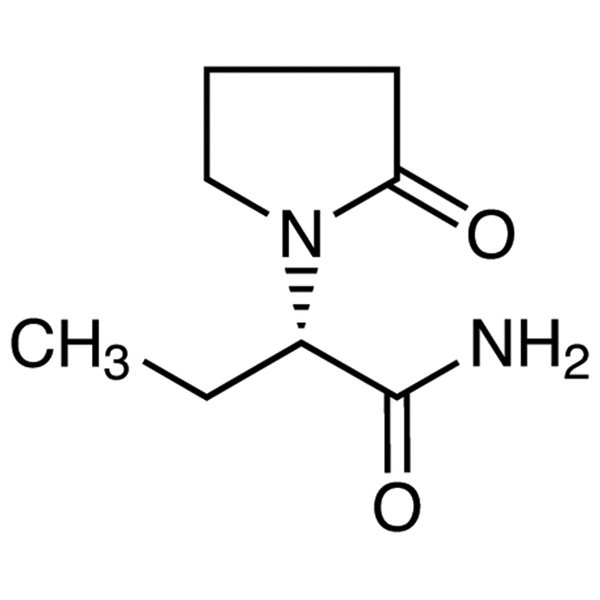
レベチラセタム LEV CAS 102767-28-2 アッセイ 98.0%~102.0% USP EP 標準
Shanghai Ruifu Chemical Co., Ltd. は、高品質で安定した品質、API、USP/EP 標準、第 3 世代抗てんかん薬を備えたレベチラセタム (CAS: 102767-28-2) の大手メーカーです。 Ruifu Chemical は、世界各地への配送、競争力のある価格、優れたサービス、少量から大量の数量まで対応可能です。レベチラセタムを購入し、 ご連絡ください: alvin@ruifuchem.com
| 化学名 | レベチラセタム |
| 同義語 | レフ; (S)-2-(2-オキソ-1-ピロリジニル)ブチルアミド; UCB-L059; (S)-α-エチル-2-オキソ-1-ピロリジンアセトアミド; (2S)-2-(2-オキソピロリジン-1-イル)ブタンアミド |
| CAS番号 | 102767-28-2 |
| 在庫状況 | 在庫、生産能力 年間 500 トン |
| 分子式 | C8H14N2O2 |
| 分子量 | 170.21 |
| 融点 | 116.0~119.0℃ |
| 密度 | 1.168g/cm3 |
| 溶解性 | アセトンに可溶 |
| COA と MSDS | 利用可能 |
| 製品の原産地 | 中国、上海 |
| 製品カテゴリー | 抗てんかん薬; API (医薬品有効成分) |
| ブランド | 瑞風化学 |
| アイテム | 仕様 |
| 外観 | 白色またはほぼ白色の結晶粉末 |
| 識別 | IR |
| 溶液の外観 | 透明で、BY6 よりも色が濃くありません |
| レベチラセタム R-エナンチオマーの限界 | ≤0.80% |
| 水(K.Fさん作) | ≤0.50% |
| 強熱時の残留物 | ≤0.10% |
| 重金属 | ≤0.001% |
| 関連物質 | |
| ピリジン-2-オール | ≤0.025% |
| レベチラセタム酸 | ≤0.30% |
| レベチラセタム関連化合物 A | ≤0.05% |
| レベチラセタム関連化合物 B | ≤0.10% |
| 個々の不特定の不純物 | ≤0.05% |
| 不特定不純物の合計 | ≤0.10% |
| 総不純物 | ≤0.40% |
| 残留溶剤 | 仕様を満たす |
| アッセイ・分析方法 | 98.0%~102.0%(無水・無溶剤ベースで計算) |
| テスト標準 | USP規格; EP規格 |
| アプリケーション | API;第 3 世代-抗てんかん薬 |
パッケージ: ボトル、アルミホイルバッグ、25kg/ボール紙ドラム、または顧客の要件に応じて。
保管状態: 容器をしっかりと閉め、不適合物質から離れた涼しく乾燥した換気の良い倉庫に保管してください。 日光を避けてください。火や熱源を避ける。湿気を避けてください。
送料: 航空便、FedEx / DHL Express で世界中に配送します。迅速かつ信頼性の高い配送を提供します。
レベチラセタム
C8H14N2O2 170.21
1-ピロリジンアセトアミド、-エチル-2-オキソ-、(S)-;
()-(S)--エチル-2-オキソ-1-ピロリジンアセトアミド [102767-28-2]。
定義
レベチラセタムは、無水および無溶媒ベースで計算して、NLT 98.0%およびNMT 102.0%のC 8 H 14 N 2 O 2 を含有する。
識別
• A. 赤外線吸収<197K>
• B. サンプル溶液からのレベチラセタムの主要ピークの保持時間は、レベチラセタム R-鏡像異性体の限界のテストで得られる、システム適合性溶液からのレベチラセタム S-鏡像異性体の保持時間に対応します。
アッセイ
• 手順
緩衝液:2.7g/Lの一塩基性リン酸カリウム水溶液。 2% 水酸化カリウム水溶液 (w/v) で pH 5.5 に調整します。
溶液 A: アセトニトリルと緩衝液 (1:19)
溶液 B: アセトニトリル
移動相: 以下のグラジエント表を参照してください。
時間 (分) 溶液 A (%) 溶液 B (%)
0 100 0
3 100 0
20 71 29
システム適合性溶液: 溶液 A に 0.2 mg/mL の USP レベチラセタム RS および 0.08 mg/mL の USP レベチラセタム関連化合物 A RS を加えます。まず、必要量の USP レベチラセタム RS を適切なメスフラスコに溶解して調製します。フラスコ容量の 10% の 0.1 N 水酸化カリウムを加えます。混合物を室温で約 15 分間反応させた後、フラスコ容量の 10% の 0.1 N 塩酸を加えて中和します。必要量の USP レベチラセタム関連化合物 A RS を加え、超音波処理して溶解し、溶液 A で定容まで希釈し、混合します。
標準溶液: 溶液 A 中の USP レベチラセタム RS 0.1 mg/mL
サンプル溶液: 溶液 A 中のレベチラセタム 0.1 mg/mL
クロマトグラフシステム
(クロマトグラフィー<621>、システムの適合性を参照。)
モード: LC
検出器: UV 205 nm
カラム: 4.6-mm × 15-cm;パッキンL1
流量: 0.9 mL/分
注入サイズ: 10 μL
システム適合性
サンプル: システム適合性ソリューション
[注-相対的な保持時間は不純物表 1 に示されています。]
適合性要件
相対標準偏差: NMT 1.0%
[注-システム適合性基準を満たせない場合は、システムを安定させるためにカラム温度を 20 ℃に維持することをお勧めします。
分析
サンプル:標準液とサンプル液
摂取したレベチラセタムの部分における C8H14N2O2 の割合を計算します。
結果 = [(rU/rS) × (CS/CU) × 100] F
rU = サンプル溶液からのレベチラセタムのピーク応答
rS = 標準溶液からのレベチラセタムのピーク応答
CS = 標準溶液中の USP レベチラセタム RS の濃度 (mg/mL)
CU = サンプル溶液中のレベチラセタムの濃度 (mg/mL)
F = レベチラセタム R-エナンチオマーの限界のテストからのレベチラセタム R-エナンチオマーのパーセンテージ
合格基準: 無水および無溶剤ベースで 98.0%-102.0%
不純物
無機不純物
• 強熱残留物<281>: NMT 0.1%
• 重金属、メソッド II<231>: 20 ppm
有機不純物
• 手順 1: レベチラセタム関連化合物 B の制限
[注-このテストは、レベチラセタム関連化合物 B が既知のプロセス不純物である場合にのみ実行してください。
緩衝液:約1.3mLのリン酸を含む1Lの水中の1.22gの1-デカンスルホン酸ナトリウム。 20% (w/v) 水酸化カリウムで pH 3.0 に調整します。
移動相: アセトニトリルと緩衝液 (3:17)
システム適合性ソリューション: 移動相中の USP レベチラセタム関連化合物 B RS 2 mg/mL
標準溶液: 移動相中の USP レベチラセタム関連化合物 B RS 0.002 mg/mL
サンプル溶液: 移動相中のレベチラセタム 2.0 mg/mL
クロマトグラフシステム
(クロマトグラフィー 621、システムの適合性を参照。)
モード: LC
検出器:UV 200nm
カラム: 4.6-mm × 25-cm;パッキンL1
流量: 1.0 mL/分
注入サイズ
システム適合性: 10 μL
分析: 50 μL
システム適合性
サンプル: システム適合性ソリューション
[注-レベチラセタム関連化合物 B の保持時間は 9 分です。]
適合性要件
テーリングファクター: NMT 3.0
[注-レベチラセタム関連化合物 B ピークの顕著なテーリングが観察された場合 (3.0 を超える)、システムを安定させるためにカラム温度を 27 に維持することをお勧めします。
相対標準偏差: NMT 2.0%
分析
サンプル:標準液とサンプル液
摂取したレベチラセタム部分に含まれるレベチラセタム関連化合物 B の割合を計算します。
結果 = (rU/rs) × (CS/CU) × (Mr1/Mr2) × 100
rU = サンプル溶液からのレベチラセタム関連化合物 B のピーク応答
rS = 標準溶液からのレベチラセタム関連化合物 B のピーク応答
CS = 標準溶液中の USP レベチラセタム関連化合物 B RS の濃度 (mg/mL)
CU = サンプル溶液中のレベチラセタムの濃度 (mg/mL)
Mr1 = レベチラセタム関連化合物 B 遊離塩基の分子量、102.1
Mr2 = レベチラセタム関連化合物 B の分子量、138.6
合格基準: NMT 0.10%
[注記-測定されたレベチラセタム関連化合物Bの量は、手順2の有機不純物の検査における総不純物に含まれます。]
• 手順 2
緩衝液、溶液 A、溶液 B、移動相、システム適合性溶液、およびクロマトグラフィー システム: アッセイの指示に従って進めます。
標準溶液: 溶液 A 中の USP レベチラセタム RS 0.005 mg/mL
サンプル溶液: 溶液 A 中のレベチラセタム 5 mg/mL
分析
サンプル:標準液とサンプル液
摂取したレベチラセタムの部分に含まれる各不純物の割合を計算します。
結果 = (rU/rs) × (CS/CU) × (1/F) × 100
rU = サンプル溶液からの各不純物のピーク応答
rS = 標準溶液からのレベチラセタムのピーク応答
CS = 標準溶液中の USP レベチラセタム RS の濃度 (mg/mL)
CU = サンプル溶液中のレベチラセタムの濃度 (mg/mL)
F = 相対応答係数 (不純物表 1 を参照)
[注-相対保持時間が 0.19 以下のピークは無視してください。]
合格基準
個々の不純物: 不純物表 1 を参照してください。
総不純物: NMT 0.4%
不純物表1
名前 相対保持時間 相対応答係数 合格基準、NMT (%)
ピリジン-2-オール a 0.37 1.0 0.025
レベチラセタム酸b 0.62 1.2 0.3
レベチラセタム 1.00 - -
レベチラセタム関連化合物 Ac 1.25 0.35 0.05
個々の不特定の不純物 - 1.0 0.05
a 総不純物制限には含まれません。
b (S)-2-(2-オキソピロリジン-1-イル)ブタン酸。総不純物制限に含まれます。
c (S)-N-(1-アミノ-1-オキソブタン-2-イル)-4-クロロブタンアミド。レベチラセタム関連化合物 B が既知のプロセス不純物である場合にのみ、総不純物制限に含まれます。
特定のテスト
• 水分の測定、方法 Ia<921>: NMT 0.5%
• レベチラセタム R-エナンチオマーの限界
移動相: n-ヘキサンと無水アルコール (4:1)
システム適合性ソリューション: 移動相中の USP レベチラセタム ラセミ混合物 RS 0.1 mg/mL
標準溶液: 移動相中の USP レベチラセタム RS 0.05 mg/mL
サンプル溶液: 移動相中のレベチラセタム 10 mg/mL
クロマトグラフシステム
(クロマトグラフィー<621>、システムの適合性を参照。)
モード: LC
検出器: UV 215 nm
カラム: 4.6-mm × 25-cm; 10-µm パッキン L51
流量: 1.0 mL/分
注入サイズ: 20 μL
システム適合性
サンプル: システム適合性ソリューション
[注-レベチラセタム R-エナンチオマーおよびレベチラセタム S-エナンチオマーの相対保持時間は、それぞれ 0.55 および 1.0 です。]
適合性要件
解像度: R- 間の NLT 4.0およびS-エナンチオマー
[注-分離能の低下 (4.0 未満) が観察された場合は、システムを安定させるためにカラム温度を 25 に維持することをお勧めします。
分析
サンプル:標準液とサンプル液
摂取したレベチラセタム部分中のレベチラセタム R-エナンチオマーの割合を計算します。
結果 = (rU/rs) × (CS/CU) × 100
rU = サンプル溶液からのレベチラセタム R-エナンチオマーのピーク応答
rS = 標準溶液からのレベチラセタムのピーク応答
CS = 標準溶液中の USP レベチラセタム RS の濃度 (mg/mL)
CU = サンプル溶液中のレベチラセタムの濃度 (mg/mL)
合格基準: NMT 0.8%
追加の要件
• 包装と保管: 密閉容器に入れて室温で保管してください。
• USP 参照規格<11>
USP レベチラセタム RS
USP レベチラセタム ラセミ混合物 RS
レベチラセタム S-エナンチオマー-(2S)-2-(2-オキソピロリジン-1-イル)ブタンアミドとレベチラセタム R-エナンチオマー (2R)-2-(2-オキソピロリジン-1-イル)ブタンアミドの 1:1 混合物。
USP レベチラセタム関連化合物 A RS
(S)-N-(1-アミノ-1-オキソブタン-2-イル)-4-クロロブタンアミド。
C8H14ClNO3 207.65
USP レベチラセタム関連化合物 B RS
(S)-2-アミノブタンアミド塩酸塩。
C4H10N2O・HCl 138.6

ピラセタムの誘導体であるレベチラセタム (CAS: 102767-28-2) は、1999 年に米国 FDA によって承認された新規の第 3 世代抗てんかん薬です。当初は成人の部分発作の補助治療に使用されていました。 2005年、レベチラセタムは、4歳以上の小児の部分発作の補助治療として経口錠剤および溶液として承認されました。主に成人および4歳以上の小児の部分発作の追加治療に使用されますが、成人の部分発作および全身発作のみに使用することもできます。また、十代の若者のミオクロニーてんかん、難治性てんかん、小児の欠神てんかん、および持続性てんかんに対しても一定の治療効果があります。