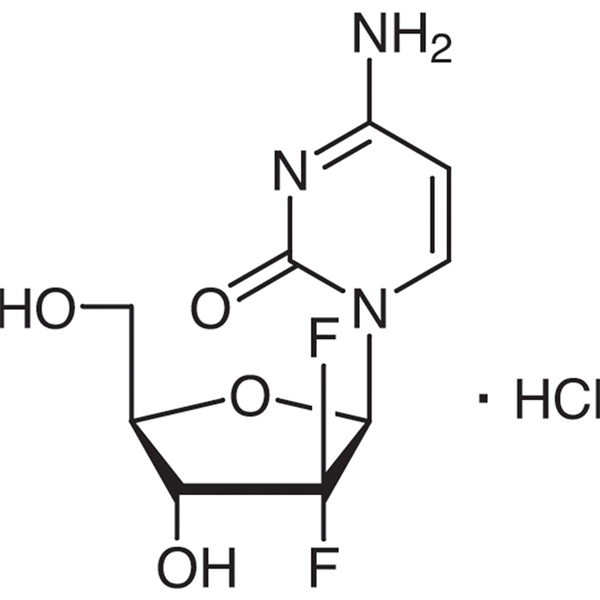
ゲムシタビン塩酸塩 CAS 122111-03-9 API USP35 標準
Ruifu Chemical は、高品質の商業生産を行う塩酸ゲムシタビン (CAS: 122111-03-9) の大手メーカーです。 Ruifu Chemical は、世界各地への配送、競争力のある価格、優れたサービス、少量から大量の数量まで対応可能です。ゲムシタビン塩酸塩を購入し、 ご連絡ください: alvin@ruifuchem.com
| 化学名 | ゲムシタビン塩酸塩 |
| 同義語 | 塩酸ゲムシタビン; 2'-デオキシ-2',2'-ジフルオロシチジン塩酸塩; dFdC; dFdCyd;ジェムザール; LY188011 塩酸塩;ゲムシテラ;ジェムサール |
| CAS番号 | 122111-03-9 |
| 関連する CAS | 95058-81-4 -フリーベース |
| 在庫状況 | 在庫あり、生産能力 5 トン |
| 分子式 | C9H12ClF2N3O4 |
| 分子量 | 299.66 |
| 融点 | >250℃ |
| 出荷状態 | 周囲温度下で |
| COA と MSDS | 利用可能 |
| 起源 | 中国、上海 |
| ブランド | 瑞風化学 |
| アイテム | 仕様 | 結果 |
| 外観 | 白色の結晶性粉末、無臭 | 準拠 |
| 溶解性 | 水に溶ける、メタノールにわずかに溶ける、 アセトンに実質的に不溶 | 準拠 |
| 識別IR | IR スペクトルは以下と一致する必要があります。 参照標準のそれ | 準拠 |
| 識別塩化物 | ポジティブ。 塩化物試験の要件を満たしています | 準拠 |
| 溶液の外観 | ソリューション S は透明で、それほど強烈ではありません 基準液BY7より着色 | 準拠 |
| pH | 2.0~3.0 | 2.6 |
| 比回転 [α]20/D | +43.0°~+50.0° | +47.5° |
| 重金属 (Pb) | ≤10ppm | <10ppm |
| 乾燥減量 | ≤1.00% | 0.3% |
| 強熱時の残留物 | ≤0.10% | 0.03% |
| 関連物質 | ||
| シトシン | ≤0.10% | 0.01% |
| α-異性体 | ≤0.10% | 0.01% |
| その他の不純物 | ≤0.10% | 0.04% |
| 総不純物 | ≤0.20% | 0.1% |
| 残留溶剤 | ||
| メタノール | ≤0.30% | 検出されませんでした |
| トルエン | ≤0.01% | 検出されませんでした |
| ジクロロメタン | ≤0.01% | 検出されませんでした |
| アセトン | ≤0.50% | 0.1% |
| アッセイ | 97.5%~101.5%(乾燥ベースで計算) | 99.9% |
| 結論 | USP35規格に準拠 | |
パッケージ: ボトル、アルミホイル袋、25kg/ボール紙ドラム、または顧客の要件に従って。
保管状態: 容器をしっかりと閉め、不適合物質から離れた涼しく乾燥した換気の良い倉庫に保管してください。 直射日光、湿気、過度の熱にさらさないでください。
送料: 航空便、FedEx / DHL Express で世界中に配送します。迅速かつ信頼性の高い配送を提供します。

リスクコード R21 -皮膚に接触すると有害
R36/38 -目や皮膚を刺激します。
R46 -遺伝的遺伝子損傷を引き起こす可能性がある
R62 -生殖能力障害のリスクの可能性
R63 -胎児に危害を及ぼす可能性のあるリスク
安全性の説明 S25 -目との接触を避けてください。
S26 -目に入った場合は、直ちに多量の水で洗い流し、医師の診断を受けてください。
S36/37 -適切な保護服と手袋を着用してください。
S53 -露出を避ける -使用前に特別な指示を得てください。
WGK ドイツ 3
RTECS HA3840000
HSコード 2942000000
塩酸ゲムシタビン (CAS: 122111-03-9) は、抗代謝性および抗腫瘍性の合成新規ジフルオロヌクレオシド薬です。イーライリリー・アンド・カンパニーによって研究開発され、1995年に南アフリカ、スウェーデン、オランダ、オーストラリアおよびその他の国での収載が承認された。米国食品医薬品局(FDA)は、それを非小細胞肺癌および膵臓癌の臨床治療の第一選択療法として承認した。
近年、ゲムシタビン、パクリタキセル、ドセタキセル、ビノレビンなどの新薬は、非小細胞肺がん(略称NSCLC)の治療に有効な薬剤である。従来の化学療法薬と比較して、これらの薬剤は治療効果が高く、毒性が低いという利点があります。塩酸ゲムシタビンは、新世代の抗代謝薬であり、細胞周期のための特殊な薬の一種であり、DNA合成期、すなわち細胞のS期で主要な役割を果たしています。この薬は、特定の条件下で、細胞のG1期からS期への進行を防ぐことができ、非小細胞肺がん(NSCLC)に対して強い抗がん作用を持っています。海外の研究では、塩酸ゲムシタビンのみによるNSCLCの単独治療の効率は約18%〜35%であるのに対し、シスプラチンと併用した場合のNSCLCの効率は41.7%であることが示されています。進行性NSCLCにおけるカルボプラチンの有効率は16%で、シスプラチンと同様ですが、特に胃腸反応、骨髄抑制、腎臓や神経終末の毒性反応に対して毒性が低いです。カルボプラチンと併用すると、両者が相互に連携し相加効果を発揮し、より高い治療効果を得ることができます。
ゲムシタビン塩酸塩
C9H11F2N3O4・HCl 299.66
シチジン、2'-デオキシ-2',2'-ジフルロ-、一塩酸塩。
2'-デオキシ-2',2'-ジフルオロシチジン一塩酸塩 (β-異性体) [122111-03-9]。
» ゲムシタビン塩酸塩は、現状ベースで計算して、97.5 パーセント以上 101.5 パーセント以下の C9H11F2N3O4・HCl を含有します。
[注意-塩酸ゲムシタビンは強力な細胞毒性物質です。粒子を吸入したり、皮膚にさらされたりしないように細心の注意を払う必要があります。]
包装と保管-密閉容器に保管してください。
ラベル 注射可能な剤形の調製に使用することを意図している場合、ラベルには、滅菌されているか、注射可能な剤形の調製中にさらなる処理を受けなければならないことが記載されています。
USP 参照規格<11>-
USP シトシン RS
USP エンドトキシン RS
USP ゲムシタビン塩酸塩 RS
識別-
A: 赤外線吸収<197K>。
B: 塩化物<191> の試験の要件を満たしています。
比回転<781S>: +43 ~ +50、20 の場合。
試験溶液: 10 mg/mL。
pH<791>:10mg/mLを含む溶液中で2.0から3.0の間。
強熱残留物<281>:0.1%以下。
重金属、方法 I<231>: 0.001%。
クロマトグラフィー純度-
ソリューション A-アッセイの移動相の指示に従って進めます。
溶液 B-濾過し、脱気したメタノールを準備します。
移動相-クロマトグラフィー システムの指示に従って、溶液 A と溶液 B のさまざまな混合物を使用します。必要に応じて調整を行います (「クロマトグラフィー 621」の「システム適合性」を参照)。
システム適合性ソリューション-アッセイの指示に従って続行します。
標準溶液|USP ゲムシタビン塩酸塩 RS および USP シトシン RS を正確に秤量し、水に溶解し、定量的、必要に応じて段階的に希釈して、それぞれ 1 mL あたり約 2 μg の既知濃度の溶液を得る。
試験溶液-ゲムシタビン塩酸塩約50mgを正確に秤量し、25mLメスフラスコに移し、水に溶解して定容し、混合する。
クロマトグラフィー システム (クロマトグラフィー 621 を参照)-アッセイの指示に従って続行します。クロマトグラフは次のようにプログラムされています。
時間 (分) A 液 (%) B 液 (%) 溶出
0–8 97 3 独裁的
8–13 97®50 3®50 直線勾配
13–20 50 50 独裁的
20–25 50®97 50®3 平衡化
システム適合性ソリューションのクロマトグラフを作成し、手順の指示に従ってピーク応答を記録します。相対保持時間は、ゲムシタビン -アノマーについては約 0.5、ゲムシタビンについては 1.0 です。ゲムシタビン -アノマーとゲムシタビン間の分離度 R は 8.0 以上です。ゲムシタビンのテーリングファクターは 1.5 以下です。標準溶液をクロマトグラフし、手順の指示に従ってピーク応答を記録します。相対保持時間は、シトシンについては約 0.1、ゲムシタビンについては 1.0 です。反復注入の相対標準偏差は 2.0% 以下です。
手順-標準液と試験液をクロマトグラフに分注し、クロマトグラムを記録し、すべてのピーク応答を測定します。ゲムシタビンの一部に含まれるシトシンの割合を次の式で計算します。
2.5(Cc / W)(rt / rs)
ここで、Cc は標準溶液中の USP シトシン RS の濃度 (μg/mL) です。 W は摂取したゲムシタビンの重量 (mg) です。 rt は、試験溶液中のシトシンのピーク応答です。 rs は標準溶液中のシトシンの応答です。検出されるシトシンは 0.1% 未満です。ゲムシタビンの一部に含まれるシトシン以外の各不純物の割合を次の式で計算します。
2.5(Cs / W)(ri / rs)
ここで、Cs は標準溶液中の USP 塩酸ゲムシタビン RS の濃度 (μg/mL) です。 W は摂取したゲムシタビンの重量 (mg) です。 ri は、試験溶液中の各不純物のピーク応答です。 rs は標準溶液中のゲムシタビンによる応答です。ゲムシタビン -アノマーまたはその他の個々の不純物は 0.1% 以下しか検出されません。すべての不純物の合計は 0.2% 以下です。すべての不純物の合計から、定量限界 (0.02%) を下回るピークを除外します。
その他の要件-ラベルに塩酸ゲムシタビンが無菌であると記載されている場合、注射用ゲムシタビンの細菌内毒素および無菌性の要件を満たしています。ラベルに塩酸ゲムシタビンが注射剤の調製中にさらなる処理を受けなければならないと記載されている場合、それは注射用ゲムシタビンの細菌内毒素の要件を満たしています。
アッセイ-
移動相 - 1000 mLの水に13.8 gの二塩基性リン酸ナトリウムと2.5 mLのリン酸を含む、濾過および脱気した溶液を調製します。 [注-この溶液の pH は 2.4 ~ 2.6 です。 】
システム適合性溶液-ゲムシタビン塩酸塩約 10 mg を小さなバイアルに移し、メタノール 1 mL あたり水酸化カリウム 168 mg を含む溶液 4 mL を加え、しっかりと蓋をし、超音波処理します。 55℃で6〜16時間加熱し、放冷し、内容物を100mLのメスフラスコに移し、1%(v/v)リン酸で連続的に洗浄する。 1% リン酸で所定の容量に希釈し、混合します。 [注-この溶液には、1 mL あたり約 0.02 mg のゲムシタビン α-アノマーが含まれています。]
標準調製|正確に秤量した USP 塩酸ゲムシタビン RS を水に溶解し、定量的に、必要に応じて段階的に水で希釈して、1 mL あたり約 0.1 mg の既知濃度の溶液を得る。
アッセイの準備|ゲムシタビン塩酸塩約 20 mg を正確に量り、200 mL メスフラスコに移し、水に溶解して定容まで希釈し、混合します。
クロマトグラフィー システム (クロマトグラフィー<621> を参照)-液体クロマトグラフには、275-nm 検出器と、5-µm の充填剤 L7 を含む 4.6-mm × 25-cm のカラムが装備されています。流量は毎分約 1.2 mL です。システム適合性ソリューションのクロマトグラフを作成し、手順の指示に従ってピーク応答を記録します。ゲムシタビン アノマーとゲムシタビン間の分解能 R は 8.0 以上です。ゲムシタビンから決定されるテーリングファクターは 1.5 以下です。標準調製物をクロマトグラフし、手順の指示に従ってピーク応答を記録します。反復注入の相対標準偏差は 1.0% 以下です。
手順-等量(約 20 μL)の標準調製物とアッセイ調製物をクロマトグラフに別々に注入し、クロマトグラムを記録し、主要ピークの応答を測定します。次の式により、ゲムシタビン塩酸塩の部分に含まれる C9H11F2N3O4・HCl の量を mg 単位で計算します。
200℃(rU / rS)
ここで、C は標準製剤中の USP 塩酸ゲムシタビン RS の濃度 (mg/mL) です。 rU と rS は、それぞれアッセイ調製物と標準調製物から得られたピーク応答です。